經(jīng)過多年的發(fā)展����,我國制藥包裝機(jī)械行業(yè)在吸收消化國外先進(jìn)技術(shù)的基礎(chǔ)上不斷創(chuàng)新����,如今已初步形成了完整的行業(yè)體系��。 制藥包裝機(jī)械為包裝業(yè)提供了重要的技術(shù)保障�����,對(duì)包裝業(yè)的發(fā)展起著重要的作用��。越來越多的包裝業(yè)人士認(rèn)為:包裝業(yè)的發(fā)展出路在于制藥包裝機(jī)械的發(fā)展����。溫度驗(yàn)證 盡管我國的制藥包裝機(jī)械行業(yè)起步比較晚�����,但是經(jīng)過幾十年的發(fā)展已經(jīng)取得了非常不錯(cuò)的成績(jī)����。如今在高新科技的推動(dòng)下���,依靠自主創(chuàng)新��,逐漸打開了國際市場(chǎng)的大門��,發(fā)展前景不可估量��。溫度驗(yàn)證儀 中國自加入世貿(mào)組織以來取得了長(zhǎng)足的進(jìn)步�,制藥包裝機(jī)械水平提升非常快����,與世界的先進(jìn)水平差距逐漸縮小。隨著中國的日益開放�����,中國的制藥包裝機(jī)械也將進(jìn)一步打開國際市場(chǎng)����。當(dāng)前中國包裝行業(yè)在國際同行中的地位明顯提高,影響力也越來越大���。溫度驗(yàn)證系統(tǒng) 據(jù)了解���,國際先進(jìn)的包裝設(shè)備供應(yīng)商已經(jīng)大舉進(jìn)入中國的各個(gè)生產(chǎn)行業(yè),并仍處于擴(kuò)張之中����,他們的產(chǎn)品以可靠的穩(wěn)定性、人性化的設(shè)計(jì)���、較高的科技含量等特性征服了很多企業(yè)�����。此種情況下��,我國的制藥包裝機(jī)械行業(yè)要揚(yáng)長(zhǎng)避短���,在不摒棄引進(jìn)和吸收的基礎(chǔ)上��,充分重視對(duì)設(shè)備研發(fā)和創(chuàng)新的投入���,以更完善的產(chǎn)品系列、...
發(fā)布時(shí)間:
2015
-
04
-
16
瀏覽次數(shù):485
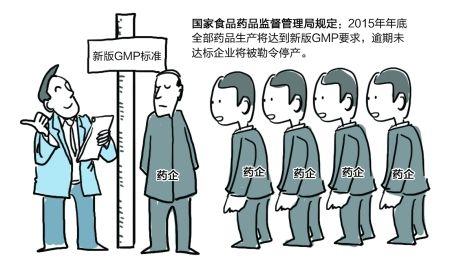
新版GMP認(rèn)證已近“尾聲”����,總體看來全國推行新版GMP認(rèn)證的過程基本上可以說是98版GMP時(shí)的“翻版”:若說招致“心照不宣”的協(xié)力抵觸絕對(duì)是有點(diǎn)過分��,但絕大多數(shù)制藥企業(yè)確實(shí)對(duì)執(zhí)行GMP缺乏主動(dòng)性��,從始至終都處于相互觀望狀態(tài)�,表現(xiàn)出一種“不見兔子不撒鷹”的淡定��。 從2006年10月國家藥監(jiān)局拿出新版GMP草案至最終于2010年10月經(jīng)衛(wèi)生部部務(wù)會(huì)議審議通過決定于2011年3月1日起施行����,期間歷經(jīng)5年修訂、兩次公開征求意見���。從制訂方面講�,不可謂不慎重����。在強(qiáng)制執(zhí)行時(shí),無菌藥品又給了一年多的“緩沖”時(shí)間�,其他類別藥品再次多給了一年。留給制藥企業(yè)認(rèn)識(shí)����、理解���、消化、準(zhǔn)備及實(shí)施新版GMP的時(shí)間應(yīng)該說是相當(dāng)?shù)某渥恪? 有了98版GMP認(rèn)證的經(jīng)驗(yàn)和教訓(xùn)后����,國家藥監(jiān)局經(jīng)過充分孕釀、科學(xué)計(jì)劃的一項(xiàng)制藥行業(yè)的系統(tǒng)工程�����,為何又重蹈“臨近最后限期扎堆過認(rèn)證”的覆轍���?值得我們行業(yè)上下一起深思�����?�! ? 在世界各國藥品市場(chǎng)“準(zhǔn)入門檻”越來越高�����,行業(yè)競(jìng)爭(zhēng)日益激烈的大環(huán)境下,如果說在我國實(shí)施GMP沒有急制藥行業(yè)發(fā)展之所急肯定有失“偏頗”�。若是說在推行時(shí)出現(xiàn)了某些問題���,沒能調(diào)動(dòng)執(zhí)行GMP的主體—制藥企業(yè)的主動(dòng)性,估計(jì)沒有幾個(gè)人會(huì)反對(duì)�。 為什么會(huì)產(chǎn)生這樣的現(xiàn)象�����?INON研工認(rèn)為監(jiān)管部門沒能針對(duì)企業(yè)“所急���、所思��、所想”加以合理引導(dǎo)是問題產(chǎn)生的根源�。 企...
發(fā)布時(shí)間:
2015
-
04
-
16
瀏覽次數(shù):741
除少數(shù)培養(yǎng)基只需加熱溶解���,不需高壓滅菌外���,大部分培養(yǎng)基均需121℃高壓滅菌15-30分鐘。尤其是對(duì)無菌試驗(yàn)培養(yǎng)基滅菌不徹底�����,直接關(guān)系到試驗(yàn)結(jié)果。因此必須認(rèn)真對(duì)高壓滅菌器進(jìn)行滅菌效果的驗(yàn)證�。 1.試驗(yàn)材料 (1)嗜熱脂肪芽胞桿菌紙片。嗜熱脂肪芽胞桿菌是本法常用的生物指示菌���,含芽胞量5-lO5 CFU/片����。 (2)121℃壓力蒸氣滅菌化學(xué)指示卡��。 (3)溴甲酚紫胨水培養(yǎng)基116℃高壓滅菌20分鐘后備用���。 (4)O-150℃留點(diǎn)溫度計(jì)����。 2.方法與結(jié)果 將嗜熱脂肪芽胞桿菌紙片(以下簡(jiǎn)稱菌片)用無菌鑷子放人密封試管中��?�;瘜W(xué)指示卡和留點(diǎn)溫度計(jì)放入敞口試管中����。以上兩種試管各準(zhǔn)備5-10份。分別放置在高壓滅菌器蒸氣口處����、底部排氣口處及底部出水口處或上下左右中間5處。如滅菌器為二層����,則需放10處。 留點(diǎn)溫度計(jì)標(biāo)化合格后方可用于驗(yàn)證試驗(yàn)����。檢測(cè)前,需將溫度計(jì)的水銀柱甩至40℃以下���。每次監(jiān)測(cè)后留點(diǎn)溫度計(jì)的溫差應(yīng)存1℃之間����,則說明滅菌器內(nèi)的溫度分布是均勻的�。溫度驗(yàn)證儀 滅菌后的菌片應(yīng)在嚴(yán)格無菌操作條件下放入滅菌后的溴甲酚紫胨水培養(yǎng)基內(nèi)56-60℃培養(yǎng)24-48小時(shí),觀察顏色變化�。如培養(yǎng)基變?yōu)辄S色,說明菌片中的嗜熱脂肪芽胞桿菌尚未完全滅活��,細(xì)菌仍可在培養(yǎng)基中生長(zhǎng)�����,分解葡萄糖產(chǎn)酸變?yōu)辄S色。如培養(yǎng)基顏色不變化仍為紫色��,則說明芽胞已滅活�����。同時(shí)要用未經(jīng)滅菌的紙片放入培養(yǎng)基內(nèi)作為陽性對(duì)照��,不加紙片的空白培...
發(fā)布時(shí)間:
2015
-
04
-
16
瀏覽次數(shù):678
國家局預(yù)計(jì)2016年1月1日將無菌GMP認(rèn)證下放至各省局,配套出臺(tái)了6個(gè)技術(shù)指南�����,分別是: 《無菌藥品檢查指南》《藥品GMP認(rèn)證申報(bào)資料技術(shù)審查要點(diǎn)》《藥品GMP認(rèn)證現(xiàn)場(chǎng)檢查工作程序》《藥品生產(chǎn)現(xiàn)場(chǎng)檢查風(fēng)險(xiǎn)評(píng)定指導(dǎo)原則》《藥品GMP現(xiàn)場(chǎng)檢查缺陷項(xiàng)目整改要求》《藥品檢查機(jī)構(gòu)評(píng)估手冊(cè)》 INON研工為大家提供上述配套技術(shù)指南資料下載: 《無菌藥品檢查指南》《藥品GMP認(rèn)證申報(bào)資料技術(shù)審查要點(diǎn)》《藥品GMP認(rèn)證現(xiàn)場(chǎng)檢查工作程序》《藥品生產(chǎn)現(xiàn)場(chǎng)檢查風(fēng)險(xiǎn)評(píng)定指導(dǎo)原則》《藥品GMP現(xiàn)場(chǎng)檢查缺陷項(xiàng)目整改要求》《藥品檢查機(jī)構(gòu)評(píng)估手冊(cè)》 掃一掃,關(guān)注INON研工官方微信
發(fā)布時(shí)間:
2015
-
11
-
25
瀏覽次數(shù):585
據(jù)悉�����,國家局2015年12月底�����,會(huì)正式對(duì)外公告下放無菌制劑GMP認(rèn)證的消息���。 國家局近日已向各省局下發(fā)了文件,要求各省局做好準(zhǔn)備�,承擔(dān)無菌藥品的GMP認(rèn)證工作。同時(shí)要求各省局完善健全認(rèn)證管理體系�,完善認(rèn)證工作程序,加強(qiáng)檢查能力建設(shè)�����,保證認(rèn)證工作質(zhì)量���。 國家局近日同時(shí)印發(fā)了《無菌藥品檢查指南》��、《藥品GMP認(rèn)證申報(bào)資料技術(shù)審查要點(diǎn)》���、《藥品GMP認(rèn)證現(xiàn)場(chǎng)檢查工作程序》���、《藥品生產(chǎn)現(xiàn)場(chǎng)檢查風(fēng)險(xiǎn)評(píng)定指導(dǎo)原則》、《藥品GMP現(xiàn)場(chǎng)檢查缺陷項(xiàng)目整改要求》��、《藥品檢查機(jī)構(gòu)評(píng)估手冊(cè)等技術(shù)指南文件》��,看來這次國家局是做了充足的準(zhǔn)備�����,確保無菌制劑GMP認(rèn)證下放后���,GMP認(rèn)證水平不降低�����,各省GMP認(rèn)證水平�����、標(biāo)準(zhǔn)盡量做到統(tǒng)一�����。 無菌GMP認(rèn)證下放早有定論國家局官網(wǎng)于2013年5月15日發(fā)布的《國家食品藥品監(jiān)督管理總局主要職責(zé)內(nèi)設(shè)機(jī)構(gòu)和人員編制規(guī)定》(俗稱“三定方案”�,主要職能、機(jī)構(gòu)設(shè)置和人員編制)�,“三定方案”規(guī)定下放的職責(zé)就包括:“將藥品、醫(yī)療器械質(zhì)量管理規(guī)范認(rèn)證職責(zé)下放省級(jí)食品藥品監(jiān)督管理部門”�。但是,方案并沒有給出明確的時(shí)間表���,該方案發(fā)布后不久,有媒體當(dāng)時(shí)發(fā)布文章認(rèn)為�����,初定時(shí)間為2015...
發(fā)布時(shí)間:
2015
-
11
-
23
瀏覽次數(shù):876
新版GMP認(rèn)證由原國家食品藥品監(jiān)督管理局自2010年起實(shí)施�,在這其中,有兩個(gè)關(guān)鍵的時(shí)間節(jié)點(diǎn)�,即生產(chǎn)血液制品、疫苗�����、注射劑等無菌藥品的企 業(yè)�,應(yīng)在2013年12月31日前達(dá)到新版GMP要求;以中藥和中藥飲片為代表的其他類別藥品的生產(chǎn)企業(yè)均應(yīng)在2015年12月31日前達(dá)到新版GMP要 求���。 按照相關(guān)規(guī)定���,未達(dá)到要求的企業(yè)�����,在上述規(guī)定期限后不得繼續(xù)生產(chǎn)藥品�����。這也就意味著��,對(duì)眾多中藥和中藥飲片企業(yè)而言��,如果在今年12月31日前仍未獲得GMP認(rèn)證�����,將不得不停產(chǎn)�。 從國家食品藥品監(jiān)督管理總局網(wǎng)站陸續(xù)發(fā)布的信息來看��,截止到今年10月底���,根據(jù)記者的統(tǒng)計(jì)���,包括安徽����、江西����、廣西等在內(nèi)的諸多省份已經(jīng)陸續(xù)公布 收回GMP認(rèn)證公告及飛行檢查情況,以安徽省為例�,今年10月份,浙江錢江(譙城)中藥材飲片有限公司�����、亳州市國苑中藥材飲片有限公司和安徽泰源中藥飲片 有限公司等3家藥品生產(chǎn)企業(yè)被吊銷《藥品生產(chǎn)許可證》���。另據(jù)統(tǒng)計(jì),全國范圍內(nèi)已經(jīng)有近20個(gè)省份的100家藥企被收回GMP證書���。值得注意的是��,其中超過 六成為中藥和中藥飲片生產(chǎn)企業(yè)�。而這些企業(yè)被收回GMP證書的原因��,也包括了檢驗(yàn)記錄造假、超范圍生產(chǎn)中藥飲片�����、質(zhì)量管理體系存在重大缺點(diǎn)等��。 對(duì)中藥和中藥飲片為代表的企業(yè)來說����,今年算是一個(gè)關(guān)鍵時(shí)間節(jié)點(diǎn)?�!敖衲晔侵兴幤髽I(yè)的專項(xiàng)檢查年度�,對(duì)于中藥企業(yè)的GMP認(rèn)證...
發(fā)布時(shí)間:
2015
-
11
-
17
瀏覽次數(shù):675