近日�,國(guó)內(nèi)多家藥企未通過(guò)歐盟GMP檢查����。據(jù)悉����,包括華北制藥集團(tuán)旗下的先泰藥業(yè)����、普洛藥業(yè)旗下的浙江普洛康裕、福建南方制藥等在此次檢查中均未能通過(guò)�,這意味著這些公司的相關(guān)產(chǎn)品將無(wú)法進(jìn)入歐盟市場(chǎng)。據(jù)悉���,未通過(guò)原因主要是存在數(shù)據(jù)管理不充分�����、分析報(bào)告造假等多重問(wèn)題��。溫度驗(yàn)證 而國(guó)內(nèi)對(duì)醫(yī)藥行業(yè)的監(jiān)管形勢(shì)也更為嚴(yán)峻��?���!吨袊?guó)經(jīng)營(yíng)報(bào)》記者日前從國(guó)家食品藥品監(jiān)督管理總局(下簡(jiǎn)稱“國(guó)家食藥監(jiān)總局”)獲悉��,2014年����,廣東、吉林���、安徽等多個(gè)省份的五十余家制藥企業(yè)的藥品GMP證書被收回。 據(jù)記者粗略統(tǒng)計(jì),被收回GMP證書的制藥企業(yè)中��,大部分為中藥生產(chǎn)企業(yè),而飛行檢查中所暴露的中西藥生產(chǎn)交替共線、涉嫌生產(chǎn)假冒中藥飲片、中藥材霉變等問(wèn)題����,也是整個(gè)中藥行業(yè)問(wèn)題的一個(gè)縮影�。 業(yè)內(nèi)人士認(rèn)為,隨著新版GMP認(rèn)證的推進(jìn)及大限的臨近�����,醫(yī)藥行業(yè)或?qū)⒂瓉?lái)重新洗牌的契機(jī)���。 2011年3月開始實(shí)施至今���,新版藥品GMP的認(rèn)證被認(rèn)為是醫(yī)藥行業(yè)重新洗牌的一個(gè)契機(jī)。 按照國(guó)家食藥監(jiān)總局的要求���,新版GMP的認(rèn)證工作有兩個(gè)時(shí)間節(jié)點(diǎn):藥品生產(chǎn)企業(yè)血液制品��、疫苗�����、注射劑等無(wú)菌藥品的生產(chǎn)���,應(yīng)在2013年12月31日前達(dá)到新版藥品GMP要求;其...
發(fā)布時(shí)間:
2015
-
04
-
16
瀏覽次數(shù):754
經(jīng)過(guò)多年的發(fā)展����,我國(guó)制藥包裝機(jī)械行業(yè)在吸收消化國(guó)外先進(jìn)技術(shù)的基礎(chǔ)上不斷創(chuàng)新,如今已初步形成了完整的行業(yè)體系��。 制藥包裝機(jī)械為包裝業(yè)提供了重要的技術(shù)保障�,對(duì)包裝業(yè)的發(fā)展起著重要的作用。越來(lái)越多的包裝業(yè)人士認(rèn)為:包裝業(yè)的發(fā)展出路在于制藥包裝機(jī)械的發(fā)展�。溫度驗(yàn)證 盡管我國(guó)的制藥包裝機(jī)械行業(yè)起步比較晚,但是經(jīng)過(guò)幾十年的發(fā)展已經(jīng)取得了非常不錯(cuò)的成績(jī)��。如今在高新科技的推動(dòng)下��,依靠自主創(chuàng)新�,逐漸打開了國(guó)際市場(chǎng)的大門,發(fā)展前景不可估量�。溫度驗(yàn)證儀 中國(guó)自加入世貿(mào)組織以來(lái)取得了長(zhǎng)足的進(jìn)步,制藥包裝機(jī)械水平提升非??欤c世界的先進(jìn)水平差距逐漸縮小。隨著中國(guó)的日益開放���,中國(guó)的制藥包裝機(jī)械也將進(jìn)一步打開國(guó)際市場(chǎng)����。當(dāng)前中國(guó)包裝行業(yè)在國(guó)際同行中的地位明顯提高���,影響力也越來(lái)越大�����。溫度驗(yàn)證系統(tǒng) 據(jù)了解���,國(guó)際先進(jìn)的包裝設(shè)備供應(yīng)商已經(jīng)大舉進(jìn)入中國(guó)的各個(gè)生產(chǎn)行業(yè),并仍處于擴(kuò)張之中���,他們的產(chǎn)品以可靠的穩(wěn)定性�、人性化的設(shè)計(jì)����、較高的科技含量等特性征服了很多企業(yè)。此種情況下���,我國(guó)的制藥包裝機(jī)械行業(yè)要揚(yáng)長(zhǎng)避短����,在不摒棄引進(jìn)和吸收的基礎(chǔ)上,充分重視對(duì)設(shè)備研發(fā)和創(chuàng)新的投入��,以更完善的產(chǎn)品系列�����、...
發(fā)布時(shí)間:
2015
-
04
-
16
瀏覽次數(shù):485
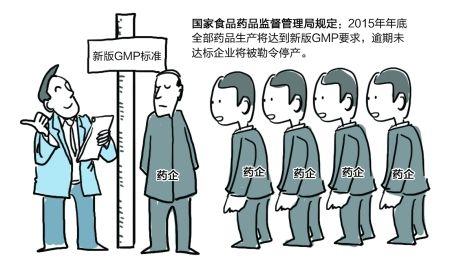
新版GMP認(rèn)證已近“尾聲”����,總體看來(lái)全國(guó)推行新版GMP認(rèn)證的過(guò)程基本上可以說(shuō)是98版GMP時(shí)的“翻版”:若說(shuō)招致“心照不宣”的協(xié)力抵觸絕對(duì)是有點(diǎn)過(guò)分���,但絕大多數(shù)制藥企業(yè)確實(shí)對(duì)執(zhí)行GMP缺乏主動(dòng)性,從始至終都處于相互觀望狀態(tài)����,表現(xiàn)出一種“不見兔子不撒鷹”的淡定。 從2006年10月國(guó)家藥監(jiān)局拿出新版GMP草案至最終于2010年10月經(jīng)衛(wèi)生部部務(wù)會(huì)議審議通過(guò)決定于2011年3月1日起施行�����,期間歷經(jīng)5年修訂��、兩次公開征求意見����。從制訂方面講,不可謂不慎重��。在強(qiáng)制執(zhí)行時(shí)����,無(wú)菌藥品又給了一年多的“緩沖”時(shí)間,其他類別藥品再次多給了一年����。留給制藥企業(yè)認(rèn)識(shí)����、理解�、消化、準(zhǔn)備及實(shí)施新版GMP的時(shí)間應(yīng)該說(shuō)是相當(dāng)?shù)某渥恪? 有了98版GMP認(rèn)證的經(jīng)驗(yàn)和教訓(xùn)后���,國(guó)家藥監(jiān)局經(jīng)過(guò)充分孕釀����、科學(xué)計(jì)劃的一項(xiàng)制藥行業(yè)的系統(tǒng)工程�,為何又重蹈“臨近最后限期扎堆過(guò)認(rèn)證”的覆轍�����?值得我們行業(yè)上下一起深思���?����! ? 在世界各國(guó)藥品市場(chǎng)“準(zhǔn)入門檻”越來(lái)越高��,行業(yè)競(jìng)爭(zhēng)日益激烈的大環(huán)境下�,如果說(shuō)在我國(guó)實(shí)施GMP沒有急制藥行業(yè)發(fā)展之所急肯定有失“偏頗”。若是說(shuō)在推行時(shí)出現(xiàn)了某些問(wèn)題�,沒能調(diào)動(dòng)執(zhí)行GMP的主體—制藥企業(yè)的主動(dòng)性,估計(jì)沒有幾個(gè)人會(huì)反對(duì)��?����! ? 為什么會(huì)產(chǎn)生這樣的現(xiàn)象�?INON研工認(rèn)為監(jiān)管部門沒能針對(duì)企業(yè)“所急、所思�、所想”加以合理引導(dǎo)是問(wèn)題產(chǎn)生的根源。 企...
發(fā)布時(shí)間:
2015
-
04
-
16
瀏覽次數(shù):741

除少數(shù)培養(yǎng)基只需加熱溶解��,不需高壓滅菌外�����,大部分培養(yǎng)基均需121℃高壓滅菌15-30分鐘��。尤其是對(duì)無(wú)菌試驗(yàn)培養(yǎng)基滅菌不徹底�����,直接關(guān)系到試驗(yàn)結(jié)果。因此必須認(rèn)真對(duì)高壓滅菌器進(jìn)行滅菌效果的驗(yàn)證�。 1.試驗(yàn)材料 (1)嗜熱脂肪芽胞桿菌紙片。嗜熱脂肪芽胞桿菌是本法常用的生物指示菌��,含芽胞量5-lO5 CFU/片�。 (2)121℃壓力蒸氣滅菌化學(xué)指示卡。 (3)溴甲酚紫胨水培養(yǎng)基116℃高壓滅菌20分鐘后備用�����。 (4)O-150℃留點(diǎn)溫度計(jì)�。 2.方法與結(jié)果 將嗜熱脂肪芽胞桿菌紙片(以下簡(jiǎn)稱菌片)用無(wú)菌鑷子放人密封試管中?����;瘜W(xué)指示卡和留點(diǎn)溫度計(jì)放入敞口試管中��。以上兩種試管各準(zhǔn)備5-10份����。分別放置在高壓滅菌器蒸氣口處�、底部排氣口處及底部出水口處或上下左右中間5處。如滅菌器為二層����,則需放10處�����。 留點(diǎn)溫度計(jì)標(biāo)化合格后方可用于驗(yàn)證試驗(yàn)��。檢測(cè)前����,需將溫度計(jì)的水銀柱甩至40℃以下���。每次監(jiān)測(cè)后留點(diǎn)溫度計(jì)的溫差應(yīng)存1℃之間�,則說(shuō)明滅菌器內(nèi)的溫度分布是均勻的����。溫度驗(yàn)證儀 滅菌后的菌片應(yīng)在嚴(yán)格無(wú)菌操作條件下放入滅菌后的溴甲酚紫胨水培養(yǎng)基內(nèi)56-60℃培養(yǎng)24-48小時(shí),觀察顏色變化���。如培養(yǎng)基變?yōu)辄S色����,說(shuō)明菌片中的嗜熱脂肪芽胞桿菌尚未完全滅活,細(xì)菌仍可在培養(yǎng)基中生長(zhǎng)�����,分解葡萄糖產(chǎn)酸變?yōu)辄S色�����。如培養(yǎng)基顏色不變化仍為紫色���,則說(shuō)明芽胞已滅活�����。同時(shí)要用未經(jīng)滅菌的紙片放入培養(yǎng)基內(nèi)作為陽(yáng)性對(duì)照�,不加紙片的空白培...
發(fā)布時(shí)間:
2015
-
04
-
16
瀏覽次數(shù):678
國(guó)家局預(yù)計(jì)2016年1月1日將無(wú)菌GMP認(rèn)證下放至各省局�,配套出臺(tái)了6個(gè)技術(shù)指南,分別是: 《無(wú)菌藥品檢查指南》《藥品GMP認(rèn)證申報(bào)資料技術(shù)審查要點(diǎn)》《藥品GMP認(rèn)證現(xiàn)場(chǎng)檢查工作程序》《藥品生產(chǎn)現(xiàn)場(chǎng)檢查風(fēng)險(xiǎn)評(píng)定指導(dǎo)原則》《藥品GMP現(xiàn)場(chǎng)檢查缺陷項(xiàng)目整改要求》《藥品檢查機(jī)構(gòu)評(píng)估手冊(cè)》 INON研工為大家提供上述配套技術(shù)指南資料下載: 《無(wú)菌藥品檢查指南》《藥品GMP認(rèn)證申報(bào)資料技術(shù)審查要點(diǎn)》《藥品GMP認(rèn)證現(xiàn)場(chǎng)檢查工作程序》《藥品生產(chǎn)現(xiàn)場(chǎng)檢查風(fēng)險(xiǎn)評(píng)定指導(dǎo)原則》《藥品GMP現(xiàn)場(chǎng)檢查缺陷項(xiàng)目整改要求》《藥品檢查機(jī)構(gòu)評(píng)估手冊(cè)》 掃一掃����,關(guān)注INON研工官方微信
發(fā)布時(shí)間:
2015
-
11
-
25
瀏覽次數(shù):585

據(jù)悉,國(guó)家局2015年12月底�,會(huì)正式對(duì)外公告下放無(wú)菌制劑GMP認(rèn)證的消息。 國(guó)家局近日已向各省局下發(fā)了文件�����,要求各省局做好準(zhǔn)備����,承擔(dān)無(wú)菌藥品的GMP認(rèn)證工作。同時(shí)要求各省局完善健全認(rèn)證管理體系���,完善認(rèn)證工作程序��,加強(qiáng)檢查能力建設(shè)����,保證認(rèn)證工作質(zhì)量����。 國(guó)家局近日同時(shí)印發(fā)了《無(wú)菌藥品檢查指南》����、《藥品GMP認(rèn)證申報(bào)資料技術(shù)審查要點(diǎn)》���、《藥品GMP認(rèn)證現(xiàn)場(chǎng)檢查工作程序》��、《藥品生產(chǎn)現(xiàn)場(chǎng)檢查風(fēng)險(xiǎn)評(píng)定指導(dǎo)原則》���、《藥品GMP現(xiàn)場(chǎng)檢查缺陷項(xiàng)目整改要求》、《藥品檢查機(jī)構(gòu)評(píng)估手冊(cè)等技術(shù)指南文件》�����,看來(lái)這次國(guó)家局是做了充足的準(zhǔn)備��,確保無(wú)菌制劑GMP認(rèn)證下放后����,GMP認(rèn)證水平不降低,各省GMP認(rèn)證水平����、標(biāo)準(zhǔn)盡量做到統(tǒng)一。 無(wú)菌GMP認(rèn)證下放早有定論國(guó)家局官網(wǎng)于2013年5月15日發(fā)布的《國(guó)家食品藥品監(jiān)督管理總局主要職責(zé)內(nèi)設(shè)機(jī)構(gòu)和人員編制規(guī)定》(俗稱“三定方案”��,主要職能���、機(jī)構(gòu)設(shè)置和人員編制)��,“三定方案”規(guī)定下放的職責(zé)就包括:“將藥品�����、醫(yī)療器械質(zhì)量管理規(guī)范認(rèn)證職責(zé)下放省級(jí)食品藥品監(jiān)督管理部門”���。但是,方案并沒有給出明確的時(shí)間表���,該方案發(fā)布后不久�,有媒體當(dāng)時(shí)發(fā)布文章認(rèn)為���,初定時(shí)間為2015...
發(fā)布時(shí)間:
2015
-
11
-
23
瀏覽次數(shù):876